(ACTUALIZACIÓN DE LA ALERTA PARA HERCEPTIN®)
Sobre la falsificación del producto Herceptin® (trastuzumab) solución 440mg y
Herceptin® SC 600 (trastuzumab) 600mg
Ciudad de México, a 13 de septiembre de 2022.- En seguimiento a la alerta sanitaria publicada el 13 de diciembre de 2021, la empresa Productos Roche, S.A. de C.V. notificó a esta Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris), que ha identificado la falsificación de los siguientes productos:
| Producto | Número de Lote | Fecha de Caducidad | Observaciones |
|---|---|---|---|
| Herceptin® 440mg | N7367B08 B3123 | 23 JUN 2022 | Reconocido por la empresa, sin embargo se detectaron productos falsificados. |
| Herceptin® SC 600 | B1082B10 | 23 ABR 2022 | El producto original caducó en 2021. |
| Herceptin® SC 600 | B2109B08 | 30 ENE 2023 | No reconocido por la empresa para Herceptin® SC 600. |
Cabe destacar que estos lotes fueron identificados adicionales los lotes N7396B 01B3129, N7396B05 B3135 y N7396 citados en la alerta del 13 de diciembre de 2021.
Características de los productos falsificados:
Herceptin® (trastuzumab) 440 mg lote N7367B08 B3123



El sello de seguridad presenta figuras con contorno color gris/tornasol, en el frasco ámpula con polvo, el fondo presenta marcas y cuenta con tapa color verde pálido.
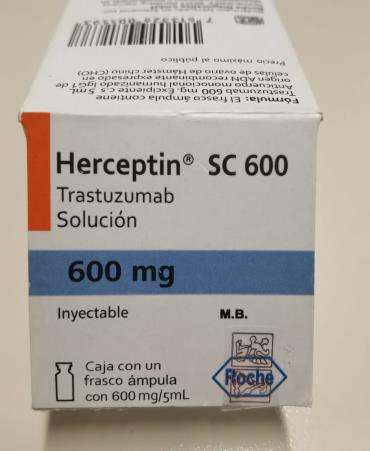
Herceptin® SC 600 (trastuzumab) 600mg lote B1082B10
El sello de seguridad presenta figuras con contorno color gris/tornasol.
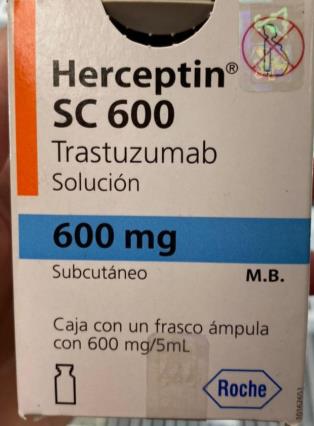
Herceptin® SC 600 (trastuzumab) 600mg lote B2109B08
Contiene la leyenda “Subcutáneo”
Por lo anterior, la Cofepris reitera las siguientes recomendaciones:
A la población:
- En caso de contar con el producto, con las características antes descritas, suspender su uso y contactar con el profesional de la salud para continuar con su tratamiento médico.
- Adquirir medicamentos sólo en establecimientos formalmente constituidos y que cuenten con licencia sanitaria o aviso de funcionamiento.
- Si ha usado los productos antes señalados, puede realizar el reporte de reacciones adversas o malestares relacionados que se hayan presentado, en la página gob.mx/Cofepris o a través del correo farmacovigilancia@cofepris.gob.mx
A los distribuidores y farmacias:
- En caso de identificar el producto con las características antes descritas, no adquirirlos y si cuentan con piezas en almacén, inmovilizarlos y realizar una denuncia sanitaria, para lo cual se pone a disposición la siguiente página de internet: https://www.gob.mx/cofepris/acciones-y-programas/denuncias-sanitarias
- Deberán adquirir el producto con proveedores autorizados y validados por la empresa titular del registro sanitario, mismos que deberán contar con licencia sanitaria y aviso de funcionamiento, asimismo, contar con la documentación de la legal adquisición del producto.
Esta Comisión Federal continuará con las acciones de vigilancia para evitar que los productos, empresas o establecimientos incumplan con la legislación sanitaria vigente y no representen un riesgo a la salud de la población.
